T.P.2 Spectrophotométrie
Ce TP a 2 parties.
Dans la 1ère on vérifie la validité de la loi de Beer-Lambert, selon laquelle l'absorbance d'une solution est proportionnelle à la concentration de l'espèce chimique colorée.
Dans la 2ème on suit par spectrophotométrie la formation d'une espèce chimique colorée lors d'une réaction lente.
1) Approche de la loi de Beer-Lambert.
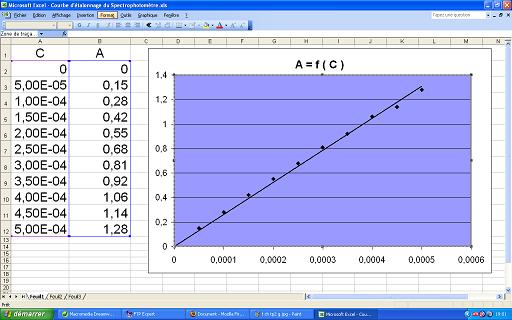
On prépare 10 solutions de permanganate de potassium de concentration C différentes et connues.
Après avoir fait le zéro du spectrophotomètre utilisé, on mesure l'absorbance A de chacune de ces solutions.
On trace la courbe A = f ( C ) et on constate qu'elle peut être assimilée à une droite d'expression : A = k . C
L'absorbance de la solution est donc proportionnelle à sa concentration en ion permanganate.
2) Suivi d'une transformation par spectrophotométrie.
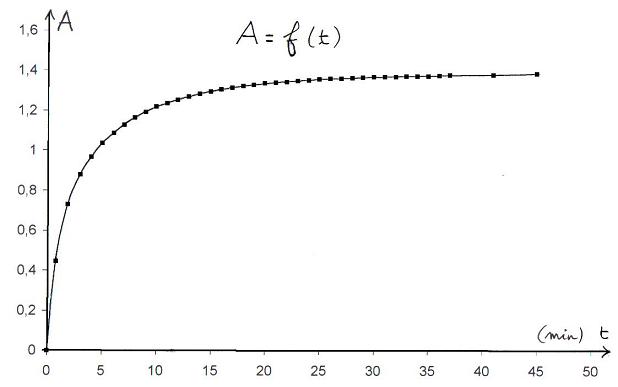
On étudie la formation de diiode lors de la réaction des ions peroxodisulfate S2O82- avec les ions iodures I-.
Avec un colorimètre, on mesure l'évolution de l'absorbance A du mélange au cours du temps.
Cette étude permet de tracer la courbe A = f ( t ).
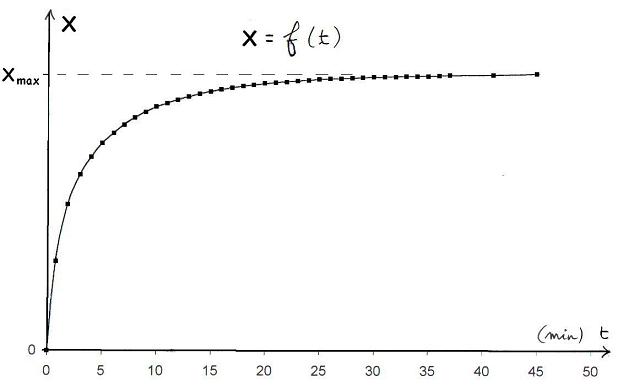
Sachant d'une part que l'absorbance du mélange est proportionnelle à sa concentration en diiode, et donc à l'avancement de la réaction étudiée, et d'autre part que la réaction s'arrête lorsque l'avancement maximal (calculé à partir des quantités initiales de réacifs) est atteint, on en déduit la courbe donnant l'avancement x en fonction du temps.