Exercice 3A.
Exercice sans calculatrice
Enoncé
a) Une réaction du dioxygène O2 sur le monoxyde d’azote NO donne du dioxyde d’azote NO2.
Ecrire l’équation de la réaction.
b) Calculer les variations des quantités de NO et NO2 pendant que celle en dioxygène est Δn(O2) = - 0,5 mol.
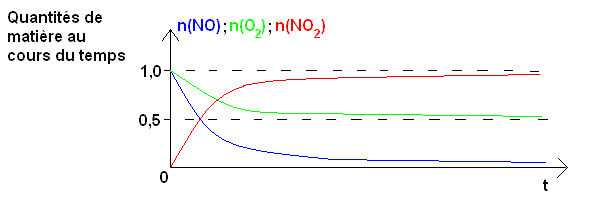
c) Tracer qualitativement sur un même graphique l’allure des courbes donnant les quantités de matière du monoxyde d’azote NO, du dioxygène O2 et du dioxyde d’azote NO2 en fonction du temps pour un mélange initial composé d’une mole de chaque réactif.
Solution
a) Equation de la réaction : . .2 NO + O2 = 2 NO2
b) A partir des coefficients stœchiométriques de l'équation précédente, on peut dire que :
Si Δn(O2) = - 0,5 mol ; . . alors Δn(NO) = - 1,0 mol . . et . . Δn(NO2) = + 1,0 mol.
c) Si il y a au début une mole de chaque réactif, la réaction s'arrêtera lorsque tout l'oxyde d'azote NO aura réagit avec 0,5 mole de dioxygène. Dans le même temps il se sera formé une mole de dioxyde d'azote.
On obtient donc les courbes suivantes :